證券代碼:300204
證券簡稱:舒泰神
公告編號:2019-49-01
舒泰神(北京)生物制藥股份有限公司
舒泰神(北京)生物制藥股份有限公司
關于STSG-0002注射液獲得新藥臨床試驗通知書的公告
1、藥品名稱:STSG-0002注射液
2、通知書號:CXSL1900065
3、申請人:北京三諾佳邑生物技術有限責任公司、舒泰神(北京)生物制藥股份有限公司
4、審批結論:根據《中華人民共和國藥品管理法》及有關規定,經審查,2019年06月27日受理的STSG-0002注射液符合藥品注冊的有關要求,同意按照提交的方案開展慢性乙型肝炎的臨床試驗。
二、藥品其他相關情況
STSG-0002注射液是具有自主知識產權的國家I類治療用生物制品,公司及子公司三諾佳邑于2019年06月18日向國家藥品監督管理局申報關于STSG-0002注射液的新藥臨床試驗申請并于2019年06月27日獲得受理,屬于“特殊審批程序”品種。
STSG-0002注射液本次申報臨床試驗的適應癥為:慢性乙型肝炎。乙型肝炎病毒(HBV)感染是嚴重威脅全球健康的主要問題之一。根據WHO發布的《Global hepatitis report, 2017》,全球有超過2.57億人慢性感染;每年有超過88.7萬人死于該病毒。中國是HBV高發國家,2006年中國HBV血清流行率調查顯示,中國1~59歲人群的HBsAg攜帶率為7.18 %。因此,估計中國約有9300萬人感染了乙肝病毒,其中2000萬為乙肝病毒慢性乙肝患者。慢性乙型肝炎給患者的生活帶來巨大的痛苦和經濟負擔。
目前在中國已上市的抗HBV核苷(酸)類(nucleos(t)ide, NAs)藥物包括核苷類的拉米夫定(Lamivudine,LAM)、替比夫定(Telbivudine, LDT)、恩替卡韋(Entecavir,ETV)和核苷酸類的阿德福韋(Adefovir, ADV)、替諾福韋(Tenfovir,TDF)。NA類藥物可通過抑制DNA逆轉錄酶活性而抑制HBV的復制,盡管現有的抗病毒治療藥物能夠有效降低患者血清中HBV DNA的拷貝數,甚至達到檢測下線水平,但是這些藥物對HBsAg(乙型肝炎表面抗原)和HBeAg(乙型肝炎E抗原)的產生無直接抑制作用。目前國際慢性乙型肝炎的治療方法均無法有效降低HBsAg抗原,其是導致肝硬化、肝癌的促進因素。此外,干擾素(interferon IFN)具有直接抗病毒作用和免疫調節作用,可有效提高機體免疫力,但只能注射給藥,持續應答率低,副作用多且治療費用高昂。
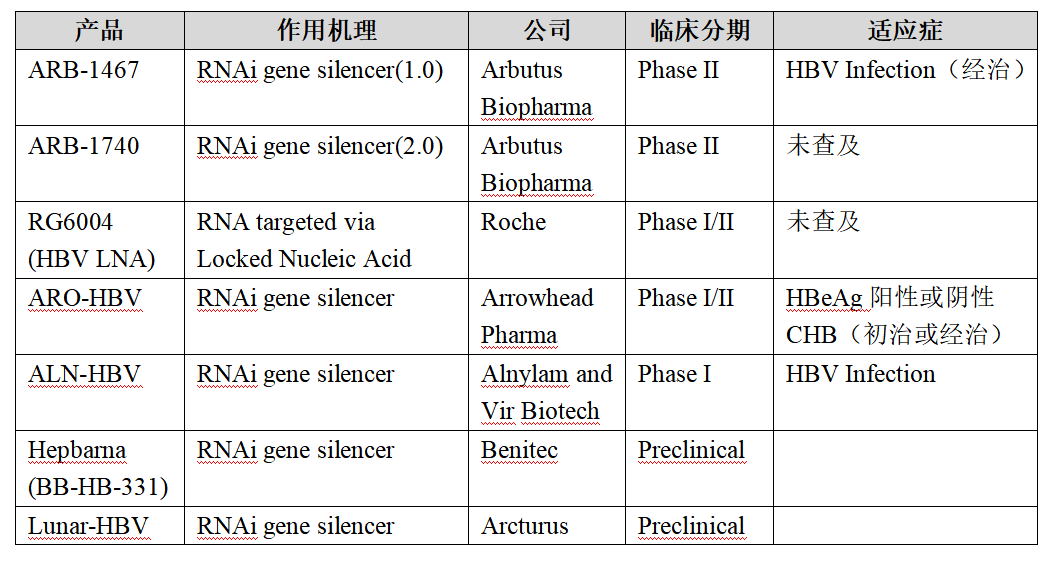
目前致力于HBV小干擾RNA作用機制的研發產品共有6家公司的7個產品,5個產品均處于臨床I期和II期。根據臨床試驗注冊情況,均以HBeAg陽性或陰性慢性乙型肝炎作為首選適應癥進行開發,具體見下表:
從作用機制上,STSG-0002注射液為攜帶靶向HBV基因組P區和X區的shRNA序列表達框的肝噬性復制缺陷重組腺相關病毒。它以重組腺相關病毒(rAAV)作為遞送載體,將目的基因序列導入細胞轉錄生成shRNA,shRNA在細胞質中剪切為單鏈siRNA,隨后通過RNAi機制,特異性地沉默HBV復制相關的pgRNA和HBV蛋白表達相關的sRNA,阻斷HBV病毒復制,降低HBsAg、HBeAg和HBc蛋白的合成和分泌。STSG-0002具有明顯嗜肝性,單次靜脈給藥可在肝細胞內長期表達siRNA。HBsAg的大幅度降低有望促進HBsAg血清轉化,從而實現HBV功能性治愈。其作用機制示意圖如下:
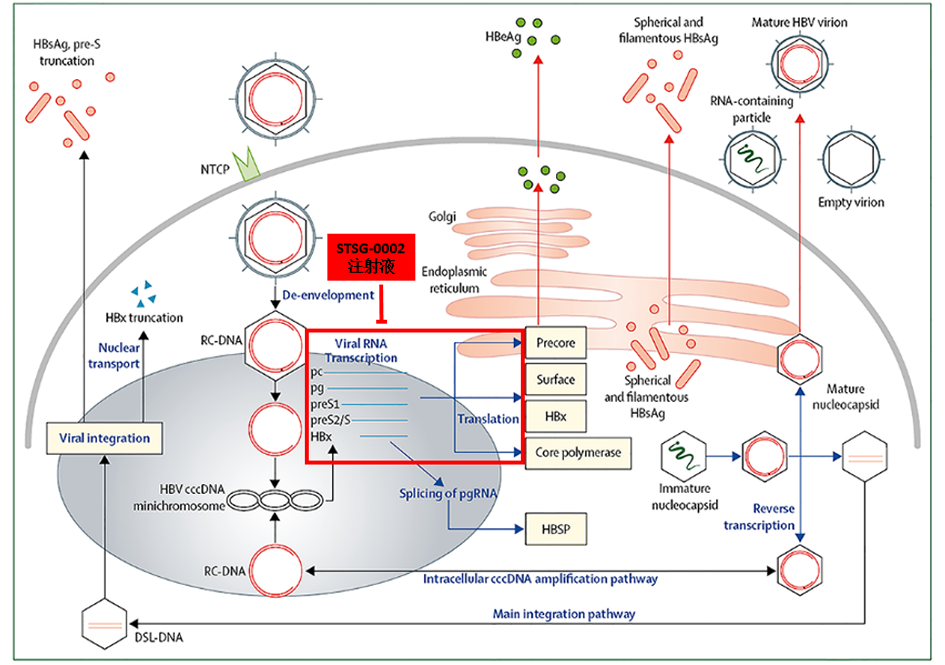
STSG-0002采用了重組腺相關病毒(rAAV)作為遞送載體,由于其具有安全性好、特異性強、遞送效率高、長期有效等特點,這一類遞送系統已經被廣泛應用于基因治療領域,截止2018年底,已經有145項以AAV作為遞送載體的臨床研究在全球開展。
基因治療藥物的生產工藝較其他生物制品更為復雜,質量研究難度大,具有較高的技術門檻。公司經過多年持續投入和積累,形成了完善的基因治療藥物研究開發體系。在此基礎上開發的STSG-0002注射液在遞送效率、生產制備工藝、質量控制等多方面均達到了同類產品的世界領先水平,具有極強的技術競爭力。
在采用HBV轉基因小鼠模型進行的臨床前有效性研究中,STSG-0002注射液表現出卓越的有效性和長效性,特別是在降低HBV相關抗原方面較已有的NAs類藥物恩替卡韋表現出明顯優勢。該研究采用NAs類藥物恩替卡韋每日給藥一次的作為對照組,而STSG-0002注射液在整個研究中只給藥一次,實驗觀察檢測周期總共長達9個月。研究發現:
1)STSG-0002注射液在給藥后的第一個檢測時間點(給藥后7天)即表現出對血清中HBV DNA滴度的明顯抑制效果,該抑制效果在整個實驗觀察期中保持穩定,直到最后一個檢測時間點(給藥后252天)未見HBV DNA滴度反彈。
2)值得關注的是,在針對HBsAg和HBeAg的檢測中STSG-0002較恩替卡韋表現出明顯的優勢。恩替卡韋給藥組未表現出與空白對照組在血清中HBsAg和HBeAg相關檢測指標的明顯差異,不能降低乙型肝炎表面抗原,而STSG-0002注射液給藥組在給藥后第一個檢測時間點(給藥后7天)即出現血清中HBsAg和HBeAg的顯著下降,該指標在給藥后14天左右達到最低值且在后續檢測中維持相對穩定(中、高劑量組可降低HBsAg至基線水平且穩定維持在這一水平直至實驗結束),直至最后一個檢測時間點(給藥后252天)未見血清中HBsAg和HBeAg顯著反彈。針對給藥9個月后動物解剖后的肝臟相關檢測發現,STSG-0002對肝臟細胞中HBsAg和HBeAg同樣表現出與血清中相關指標類似的的顯著抑制效果。
小核酸基因藥物STSG-0002注射液無明顯全身毒性、生殖毒性、局部刺激性、免疫毒性、過敏性和溶血性風險,主要毒性靶器官為肝臟,表現為可逆性的輕微至輕度肝細胞壞死、膽管增生、炎細胞浸潤。以上均屬于本品的藥理學作用及藥理學作用的延伸相關。
STSG-0002注射液是具有自主知識產權的I類新生物制品,全新靶點,全球范圍內尚無該靶點基因藥物上市銷售。STSG-0002注射液項目的研發成功將有效解決現有乙型肝炎患者抗病毒治療方案不能直接降低HBsAg(乙型肝炎表面抗原)等HBV相關結構蛋白和調節蛋白的問題,有效降低HBV攜帶者肝臟HBV復制帶來的慢性炎癥,從而阻止慢性乙型肝炎患者向肝硬化、肝癌等重型肝病的進展,并將對HBV感染相關重癥疾病帶來新的治療手段。
三、風險提示
本次公司獲得STSG-0002注射液臨床試驗通知書,暫不會對公司業績產生重大影響。本次獲得新藥臨床試驗通知書僅是新藥研發進展的階段性步驟,后續能否獲得國家藥品監督管理局的生產批件、獲準上市尚存在諸多不確定。公司將積極推進上述研發項目,并按有關規定對該項目后續進展情況及時履行信息披露義務。
由于醫藥產品具有高科技、高風險、高附加值的特點,藥品的前期研發以及產品從研制、臨床試驗報批到投產的周期長、環節多,容易受到技術、審批、政策等諸多因素影響。
特此公告
董事會
2019年09月19日

