單克隆抗體藥物 BDB-001注射液 中重度化膿性汗腺炎
【作用機制】
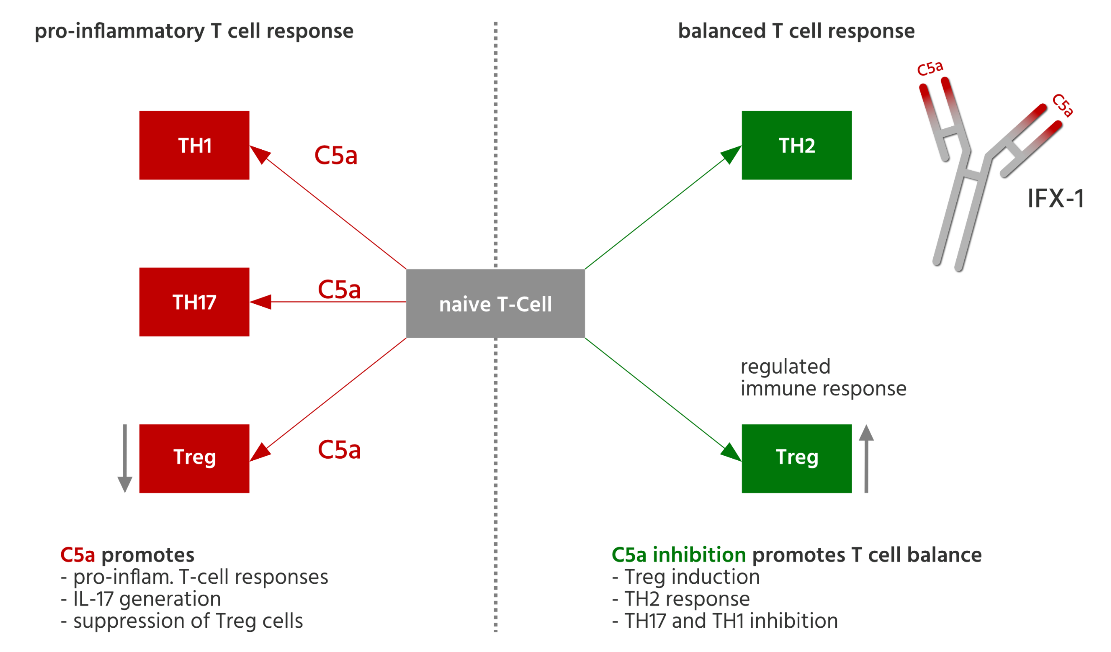
從作用機理上,單克隆抗體藥物“BDB-001注射液”針對的靶點是C5a。C5a具有強烈的趨化作用,可以誘導中性粒細胞、嗜酸粒細胞和單核細胞向炎癥部位的移動。此外,C5a對免疫應答有明顯增強作用,可誘導單核細胞分泌IL-1、IL-6、IL-8及TNF-a等細胞因子。因此提示阻斷C5a具有對HS強有力的治療潛力,其可以有效控制導致HS關鍵致病因素的炎癥因子水平,從而控制HS相關疾病癥狀。
(原鏈接:https://www.inflarx.de/Home/Research---Development/About-C5A.html)
【擬適應癥】
化膿性汗腺炎(Hidradenitis suppurativa,HS),又名反常性痤瘡(Acne inversa,AI),是一種具有家族傾向、反復發作、慢性炎癥性皮膚病,其常見臨床表現為黑色粉刺、疼痛的囊腫、膿腫以及頂漿腺聚集區域出現的竇道。多發于葉腋、乳房下皺襞、腹部皺襞、腹股溝、臀部和大腿內側。疾病引起的疼痛、慢性化膿和持續惡臭給患者的生活帶來很大的痛苦以及巨大的經濟負擔。
全球報告HS不同時期,不同區域HS患病率不同。90年代Jemec GB等研究顯示全球患病率范圍在1%~4%之間。近代Zouboulis等研究顯示歐洲平均患病率為6/10萬,平均患病率為1%。而Cosmatos等研究發現美國患病率為0.053%,估計有146,000~162,000例患者。法國最近的一項大型流行病學調查報告顯示,患病率為0.97%。英國患病人數估計10萬左右,每年住院治療患者超過2000人,根據臨床登記HS患者數量估計患病率為0.25%~8%。國內尚未見對HS的流行病學調查報告。
根據病情嚴重程度,目前臨床上主要采取抗菌藥物、激素、局部切除、放療等綜合治療手段對HS進行治療。各種治療目的都是盡早控制病情,阻止新皮損的出現,防止瘢痕和竇道形成。Hurley分期較高表明膿腫更多和影響區域更大,其中Hurley I期的治療方法包括抗菌藥物(外用或全身應用)、內分泌治療、維A酸、鋅制劑、冷凍治療、肉毒桿菌毒素、射頻治療、短程口服或局部注射糖皮質激素治療,II期的治療方法包括CO2激光、免疫抑制劑治療、局部切除、放射治療、射頻治療,III期的治療方法包括放射治療、廣泛性切除、竇道切開。但對于Hurley II期和III期HS患者,各種治療方法均存在愈合不佳,常見復發的問題。國內外生物制劑僅阿達木單抗(Adalimumab)于2015年9月經FDA批準作為中重度化膿性汗腺炎治療藥物。此外,目前正處在臨床研究階段生物制劑還包括TNF-a抑制劑英夫利昔單抗(Infliximab)、依那西普(Etanercept)和IL-1受體拮抗劑。中國尚無HS有效治療藥物。
【研發藥物介紹】
補體作為機體天然免疫中的重要成分,對消除外來抗原的侵害、維護機體內環境的平衡具有重要作用;但是補體的過度激活則可誘導炎癥反應并影響凝血及纖溶系統,可引起病理性損傷。
本項目為抗人補體成分C5a的重組單克隆抗體注射液。C5a通過結合其受體C5aR發揮其生物學功能。該單克隆抗體藥物通過特異性結合補體成分C5a,使C5a喪失結合受體的能力,從而阻斷其誘導的生物學功能,如中性粒細胞趨化、細胞內溶菌酶的釋放、炎癥因子水平的上升和氧呼吸爆發等。最近關于C5aR的研究表明,C5a-C5aR信號通路可能在腫瘤發生中具有重要作用。C5a在人體內具有廣泛作用和重要的生理學功能,以C5a為靶點的相關藥物未來具有廣泛的臨床用途和重大的市場價值。
基于臨床開發策略考慮,單克隆抗體藥物BDB-001注射液本次申請的適應癥為中重度化膿性汗腺炎,針對特定人群的臨床重要且急需治療的疾病進行開發,使得新靶點、新作用機制的藥物得以盡早上市,并在未來通過更廣泛的臨床研究,不斷擴展臨床應用。
在全球研發項目中,德國InflaRx公司研發的IFX-1,為重組抗人C5a人源化單克隆抗體,目前在國際上處于II期臨床開發階段,用于治療中重度化膿性汗腺炎。此外IFX-1已在美國、歐盟、加拿大陸續展開包括中重度化膿性肝腺炎、抗中性粒細胞胞漿抗體(安卡,ANCA)相關性血管炎(AAV)和壞疽性膿皮病(PG)在內的三個適應癥的多個II期臨床研究。德豐瑞持有德國InflaRx GmbH公司授權的“InflaRx技術”在中國的獨家經營權,包含產品開發、市場營銷和商業化的權益。
理論上阻斷C5a或其受體C5aR應當具有類似的生物學效果。公司也在密切關注針對C5aR開發的相關藥物的研究情況。ChemoCentryx公司的小分子CCX168是針對過敏毒素受體(C5aR)的抑制劑,現已經完成的兩項II期研究表明,抗中性粒細胞胞漿抗體(安卡,ANCA)相關性血管炎(AAV)患者對此藥物耐受性良好,且能顯著降低患者的激素使用量,從而減輕高劑量激素治療給患者帶來副作用。目前該藥物針對抗中性粒細胞胞漿抗體(安卡,ANCA)相關性血管炎(AAV)的臨床III期研究正在美國、歐洲、日本進行中。此外,該藥物還在開展針對C3腎小球病的II期臨床研究和針對HS的I期臨床研究。2018年11月,MorphoSys與天境生物聯合宣布就腫瘤免疫創新生物藥 MOR210 開發達成總金額為1.05億美元的戰略合作。MOR210是針對C5aR的抗體,MOR210是MorphoSys在腫瘤免疫學方面的重要發現,研究者認為MOR210直接阻斷C5aR從而改變腫瘤發生的微環境。目前該藥物處于臨床前研究階段。
【臨床前安全數據摘要】
單克隆抗體藥物BDB-001注射液以充分代表臨床試驗擬用樣品的劑量進行食蟹猴的單次、重復給藥毒性試驗等,綜合已經完成的毒理學研究結果,單克隆抗體藥物BDB-001注射液具有良好的安全性和較強的免疫原性。
【擬定臨床方案摘要】
擬進行一項隨機、雙盲、安慰劑對照、單劑量遞增評價單克隆抗體藥物BDB-001注射液在健康受試者中的安全性、耐受性及藥代動力學I期臨床試驗方案,以評價單克隆抗體藥物BDB-001注射液單次靜脈給藥在健康受試者中的安全性和耐受性;評價健康受試者單克隆抗體藥物BDB-001注射液藥代動力學(PK)、藥效動力學(PD)及免疫原性特征。
【產品核心優勢及特點】
本項目是針對C5a靶點的國內首家、最早進入臨床研究的全球全新靶點的全球創新藥物,針對該靶點和藥物結構形成了完善的知識產權布局,有望為自身免疫系統疾病的藥物治療提供新的解決路徑。
【申報歷程】
2018年07月11日,公司收到國家藥品監督管理局簽發的單克隆抗體藥物“BDB-001注射液”《藥物臨床試驗批件》:
批件號:2018L02687
劑型:注射劑
規格:10ml:100mg
注冊分類:治療用生物制品I類
審批結論:批準本品進行臨床試驗。
2018年02月07日,公司收到國家食品藥品監督管理總局行政許可文書《受理通知書》:
受理號:CXSL1800015國
申請事項:新藥申請:減或者免臨床研究;特殊審批程序
申請階段:臨床
擬定適應癥:中重度化膿性汗腺炎。
2018年01月30日,公司向國家食品藥品監督管理總局提交了關于單克隆抗體藥物“BDB-001注射液”的新藥臨床試驗申請。

